Expérience 4 : Congeler un aliment : qui est le plus rapide ? – Travaux d’étudiants BTSA STA de l’ENILBIO de Poligny (à distance !)
Retour d’expérience des étudiants BTSA Sciences et technologies des aliments, Aliments et processus technologiques de travaux effectués à distance durant le confinement
Lien vers la formation suivie : https://www.enil.fr/formations/bts/btsa-sta-aliments-technologies
Modalités :
- travailler « à distance » par groupe si vous le souhaitez.
- réaliser les manipulations à la maison, avec les moyens dont vous disposez.
- rendre les résultats de vos essais, calculs.
- envoyer quelques photos de vos expériences ou réalisations.
Travail demandé :
- Illustrer par l’expérience la loi de Raoult (appliquée à la surgélation). Indice : c’est l’inverse du processus observé lors de la concentration.
- Indiquer comment évolue la température de solidification en fonction de la concentration en soluté du produit.
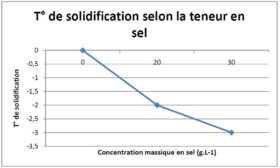
Par Jonathan :
Faute de pouvoir faire un suivi continu les valeurs ne sont pas précises.
 |
 |
Conclusion :
Plus un produit est concentré plus la température de solidification est basse, car le soluté modifie la capacité thermique du liquide dans lequel il est dissous. La capacité thermique du soluté est généralement supérieure à celle de l’eau.
En conséquence il faut retirer plus d’énergie pour baisser la température de 1°C et l’énergie à retirer pour le changement d’état augmente.
Par Chloé et Valentin :
L’illustration de cette expérience que nous avons choisie est de comparer le temps de surgélation de l’eau du réseau et de l’eau du réseau sucrée (nous avons rajouté du sucre en poudre dedans).
Grâce à cette expérience, nous pouvons constater que la température de surgélation diminue lorsque le produit est plus concentré.
Observation : la bouteille contenant l’eau du réseau simple s’est solidifiée plus rapidement que celle contenant l’eau sucrée.
Par Marine :
Produits choisis : confiture de mûr maison / même confiture dilué dans 10 mL d’eau
Temps de solidification : le produit dilué s’est solidifié au bout d’une heure. Tandis que le produit concentré ne s’est toujours pas solidifié à T+2h.
Ainsi, plus le produit est concentré, plus la température de solidification diminue (plus proche de -18°C). Lorsqu’il est dilué (soit constitué d’eau) il solidifie à une température plus proche de 0°C.
Par Léonie et Léo :
Nous avons voulus faire 3 glaçons différents en concentration. Il y avait :
- un d’eau,
- un d’eau et de sirop de grenadine,
- un de sirop de grenadine seulement.
L’eau a congelé au bout d’une heure dans un congèle à -18°C. L’eau plus le sirop de grenadine a mis 2 heures à congeler. Le sirop de grenadine seul a congelé au bout de 24 heures.
Plus le produit est concentré, plus il met du temps à ce congelé.
Par Elise, Mélanie et Lucas :
Illustration de la loi de Raoult :
On peut voir que le produit le plus concentré se solidifie après celui qui est moins concentré.
Comment évolue la T°C de solidification en fonction de la concentration en soluté du produit ?
Plus un produit est concentré en soluté dans un produit (exemple : sucre, sel …) plus la T°C de solidification de ce produit sera basse.
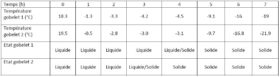
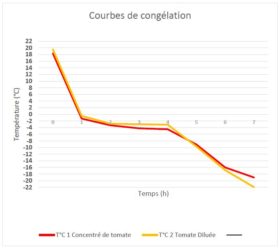
Par Maxence :
Photos du matériel permettant d’effectuer l’expérience.
Le test sera sur le concentré de tomate.
Matériel :
- Congélateur, Température : -20°C
- 2 gobelets en plastiques
- Thermomètre à sonde
Expérience :
- Dans le gobelet 1, je verse du concentré de tomates (= 86 g).
- Dans le gobelet 2, je verse du concentré de tomate dilué: 43 g de tomate et 43 g d’eau soit une dilution de 50 %.
J’ai relevé la température à chaque heure et observé sa consistance.
Observations :
- La température des échantillons chute fortement au bout de 1 heure, les 2 températures sont en négatives et les produits sont liquides.
- Pendant les 3 heures suivantes, la température des 2 produits évoluent peu. Durant cette phase plateau, la température du produit dilué (concentration en eau plus importante) est légèrement plus basse que celle du produit concentré. De plus, le produit concentré reste liquide et commence à ce solidifié après 3 heures de phase plateau. En revanche, le produit dilué est totalement solidifié 1 heure avant le produit concentré.
- A l’issu de la phase plateau, la température des 2 produits chute plus progressivement en fonction du temps de stockage dans le congélateur.
- La température de solidification (texture liquide/solide) est plus basse pour le produit concentré (environ -4,5°C) que le produit dilué (environ -3.1°C).
Conclusion :
- La loi de Raoult, appliquée à la congélation, précise que “l’abaissement de la température de congélation de la solution est proportionnel à la concentration molaire en soluté“.
- Dans cette expérience, on constate que plus le produit est concentré, plus il prendra de temps à se solidifier. De même, la température de congélation du produit concentré est plus basse que celle du dilué.
Par Mylène et Florianne :
La loi de Raoult nous dit que plus un produit est concentré, plus sa température d’ébullition augmente. A l’inverse plus un produit est concentré plus, plus sa température de congélation diminue.
Pour illustrer cette loi nous aurons deux récipients, qui contiendront 1/10 de L chacun. L’un contient du sirop pur (Bol bleu) alors que l’autre contient du sirop dilué avec de l’eau (Bol orange).
Notre expérience a donc bien démontré les propriétés de la loi de Raoult. Une expérience similaire a été menée avec de l’eau avec deux différents taux de sucre. Le résultat était moins significatif car les différences étaient moins grandes, mais l’on pouvait constater en cassant la glace que le plus dilué était plus recouvert de glace (gobelet orange) que le moins dilué (gobelet bleu).
Par Louise, Léo, Neven et Sacha :
Pour cette expérience, nous avons utilisé deux bouteilles d’eau dont l’une avec l’ajout d’une certaine quantité de sirop. On a pu observer que la bouteille d’eau avec le sirop au bout de deux heures n’était toujours pas glacée, tandis que la bouteille avec uniquement de l’eau était glacée.
Par Valentine :
Pour cette expérience, j’ai mis au congélateur dans une verrine de l’eau et dans une autre du sirop de menthe. En effet, j’ai pu constater que l’eau avait congelé au bout de 1H (-18°C), mais pas le sirop. Je suis retourné voir 24H après, et toujours aucun résultat.
La température de solidification diminue en fonction de la concentration en soluté du produit. Ici, l’eau s’est solidifiée à une température de -18°C, le sirop de menthe se solidifiera à une température inférieure à -18°C.
Par Agathe :
Plus un produit est concentré, plus il mettra du temps à « gelé ».
Un verre rempli de sirop pur / un verre de sirop dilué avec de l’eau. Le verre rempli avec du sirop pur mettra plus de temps à « geler » que le verre de sirop dilué. Cela s’explique par la composition du sirop : le sirop a une concentration importante en sucre.
Par Sarah et Christal :
Pour illustrer la loi de Raoult nous avons choisi une expérience simple mais efficace visant à démontrer que la vitesse de congélation varie selon la concentration d’un soluté.
Ici nous avons pris un sirop et de l’eau et avons placé la même quantité dans deux verres avant de les mettre aux congélateurs pendant 45 minutes.
Le constat est sans appel, l’eau à gelé alors que le sirop est simplement devenu un petit peu plus dense.
Effectivement plus le produit est concentré plus la température de gélification est basse, il est donc normal que l’eau se solidifie en premier.
Par Maxence et Hugo :
L’expérience est la suivante :
- On peut mettre du jus d’orange et de l’eau au congélateur à 0°C pendant 6 heures.
- On mettra le même volume d’eau et de jus d’orange pour pouvoir comparer les résultats.
L’eau devrait geler tandis que le jus d’orange qui contient du sucre ne devrait pas geler selon la loi de Raoult.
Plus la concentration en soluté du produit augmente, plus la température de solidification diminue. Par exemple, il faudra davantage diminuer la température du sirop afin de réaliser sa solidification, que celle d’un jus de fruit.
Par Elisa :
Pour illustrer la loi de Raoult appliquée à la température de surgélation, j’ai réalisé une expérience avec de l’eau et du sirop pur. J’ai rempli un portoir à glaçons avec ces 2 liquides. J’ai mis le tout au congélateur.
Pour analyser la loi de Raoult, j’ai décidé de vérifier la solidification des 2 liquides toutes les 30 min.
- Après 30 min : l’eau gèle partiellement en surface alors que le sirop reste liquide.
- Après 1h : l’eau gèle complètement en surface mais l’intérieur reste liquide. Le sirop quant à lui reste liquide.
- Après 1h30 : l’eau reste gelée en surface mais l’intérieur se transforme en paillette. Le sirop reste toujours liquide.
- Après 2h : l’eau est devenu un glaçon alors que le sirop n’a pas bougé depuis le début, il est encore liquide.
Nous pouvons rappeler la loi de Raoult : plus le produit est concentré, plus la température de solidification est basse. On peut traduire cette loi en disant que le produit qui mettra le plus de temps à se solidifier sera le produit le plus concentré. A la suite de notre expérience, on remarque que le produit le plus long à se solidifier est le sirop pur. Si on suit le raisonnement, le sirop possède donc une température de solidification basse. Par conséquent, c’est le produit le plus concentré par rapport au sirop dilué. De plus, il convient de préciser que la température du congélateur ne dépasse pas -18°C. On en déduit que si le sirop ne se solidifie pas, c’est aussi dû au fait que sa température de solidification est inférieure à -18°C.
Par Lucie, Claire et Aurélien :
La loi de Raoult (concentration) dit que plus la concentration est élevée plus la température d’ébullition augmente.
La loi de Raoult (surgélation) dit que plus la concentration est élevée plus la température de surgélation est basse.
Pour illustrer cette expérience, nous avons utilisé du jus de fraises (produit non concentré) et de la confiture de fraises (produit concentré). Dans chaque ramequin, il y avait une masse de 72 g. Pour être sûr d’avoir la même température de base, on les a refroidi au réfrigérateur pendant 24 h. Le lendemain matin, nous avons mis les deux ramequins en même temps au congélateur et toutes les 30 minutes nous allions vérifier la solidification des produits.
Pour réaliser cette expérience nous étions équipés d’un thermomètre qui ne descendait pas en dessous de 0°C. Nous avons décrit ce qu’on observait.
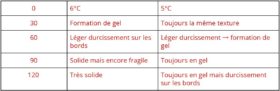 |
Avec cette expérience nous pouvons constater que le produit le moins concentré se durcit plus vite, il a donc une température plus élevée que le produit concentré.
Par Lénaïc :
Pour réaliser cette expérience, j’ai mis au congélateur une bouteille d’eau et une bouteille d’eau avec du sirop.
On peut donc en conclure que plus le produit concentré, plus le temps de refroidissement est long.
Par Ma-You :
On observe que l’eau descend pus vite en température que le ketchup. En effet, l’eau est un produit moins concentré comparé au ketchup. Plus le produit est concentré, plus la durée de surgélation va être longue. Donc plus la température de surgélation va être basse.
Contact : Arielle BRENDLE, arielle.brendle@educagri.fr
Rétrolien depuis votre site.